再生医療の分野において、臍帯由来間葉系幹細胞(UC-MSC)はその採取の容易さや高い増殖能、そして低い免疫原性から、極めて有望な細胞ソースとして注目を集めています。しかし、研究室レベルの成果を実際の臨床応用や産業化へと繋げるためには、解決すべき技術的課題が少なくありません。特に、品質を維持しながらコストを抑え、かつ大量に製造するための「培養技術の最適化」は、多くの技術者様や研究開発担当者様が頭を悩ませるポイントではないでしょうか。
本記事では、UC-MSCの培養技術における最新のトレンドから、培地選定の勘所、プロトコルの微調整、そして3次元培養によるスケールアップまで、実用的な視点で解説します。産業化を見据えた製造ラインの構築や、既存プロセスの改善にお役立ていただければ幸いです。
臍帯由来MSC(UC-MSC)培養技術の現在地と産業化への最適解
UC-MSCの産業化を目指す上で、研究レベルの培養手法をそのままスケールアップするだけでは、品質の安定性やコスト面で限界に直面することがあります。ここでは、臨床応用を前提とした培養技術のトレンドと、産業化に向けた最適なアプローチについて解説します。規制要件を満たしつつ効率的な製造ラインを構築するための、基本的な考え方を整理しましょう。
臨床応用を見据えた「ゼノフリー(Xeno-free)」と「無血清培養」への移行
臨床グレードの細胞製造において、動物由来成分を含まない「ゼノフリー(Xeno-free)」や、血清そのものを使用しない「無血清培養」への移行は、もはや必須の流れとなりつつあります。ウシ胎児血清(FBS)などは未知の病原体混入リスクやロット間差が懸念されるためです。
規制当局のガイドラインに適合するためにも、早期の段階から成分が明確な培地系への切り替えを検討することが重要です。これにより、安全性の担保だけでなく、製造プロセスの再現性を高めることが可能となります。
手技への依存を脱却する自動培養装置および閉鎖系システムの導入
熟練した技術者の手技に依存する培養プロセスは、人為的なミスや汚染(コンタミネーション)のリスクを常に抱えています。また、人件費の高騰も製造コストを圧迫する要因となります。
そこで注目されているのが、自動培養装置や閉鎖系システムの導入です。これらは無菌性を高度に維持しながら、均一な操作を可能にします。初期投資は必要ですが、長期的には品質の安定化と運用コストの削減に寄与し、産業化への大きな一歩となるでしょう。
ロット間差を最小化するためのドナースクリーニングとマスターセルバンク(MCB)構築
UC-MSCはドナー(提供者)ごとの個体差が大きく、これが最終製品の品質にバラつきを生じさせる主因の一つです。安定した製造を行うためには、厳格なドナースクリーニングを経て、増殖能や分化能に優れた細胞を選抜する必要があります。
さらに、選定された細胞からマスターセルバンク(MCB)およびワーキングセルバンク(WCB)を構築することが推奨されます。これにより、同一ソースからの細胞供給が可能となり、ロット間の品質差を最小限に抑えることができるのです。
UC-MSCの増殖効率と未分化能維持を左右する培地・基質の選定
細胞にとっての「食事」であり「住環境」である培地や基質の選定は、UC-MSCのパフォーマンスを決定づける最も重要な要素の一つです。コストと性能のバランスを見極めながら、目的に応じた最適な組み合わせを見つけ出す必要があります。ここでは、主要な培地添加物と基質の特徴について比較検討します。
従来のウシ胎児血清(FBS)添加培地が抱える安全性と供給リスク
長年スタンダードとして使用されてきたウシ胎児血清(FBS)ですが、再生医療の製品化においては、プリオンやウイルスなどの感染リスクが懸念材料となります。また、世界的な需要増に伴う供給不足や価格高騰も無視できない問題です。
さらに、FBSに含まれる成分のロット間差は、実験結果や製造品質の再現性を損なう可能性があります。研究初期段階では有用ですが、臨床応用を見据えた場合は、代替品への切り替えを計画的に進めることが望ましいでしょう。
ヒト血小板溶解液(hPL)添加培地の有用性と凝固阻止剤の調整
FBSの有力な代替として普及しているのが、ヒト血小板溶解液(hPL)です。hPLは豊富な成長因子を含み、UC-MSCに対してFBSと同等以上の高い増殖促進効果を示すことが知られています。ヒト由来であるため、異種動物由来のリスクも回避できます。
ただし、hPLを使用する際は、培地中での凝固を防ぐためにヘパリンなどの凝固阻止剤の添加や濃度調整が必要です。適切な調整を行わないと、ゲル化により培養環境が悪化するため注意しましょう。
化学組成が明らかな完全合成培地(Chemically Defined Media)の採用メリット
完全合成培地(Chemically Defined Media: CDM)は、すべての成分が化学的に特定されているため、ロット間差が極めて少なく、高い再現性を実現できます。成分がブラックボックス化していないことは、規制当局への申請時にも大きなメリットとなります。
一方で、FBSやhPL添加培地に比べて細胞増殖速度が劣る場合や、コストが高くなる傾向があります。しかし、品質管理の容易さと安全性の高さは、大規模な商業生産において強力な武器となるはずです。
細胞接着を促進するコーティング剤と細胞外マトリックス(ECM)の活用
無血清培地や合成培地を使用する場合、細胞の足場となる接着因子が不足し、増殖効率が低下することがあります。これを補うために、フィブロネクチンやラミニン、あるいは独自配合の細胞外マトリックス(ECM)によるコーティングが有効です。
適切な基質を選択することで、細胞の接着伸展が促進され、増殖シグナルが活性化します。また、未分化性の維持にも寄与するため、培地とセットでの最適化検討をおすすめします。
培養プロトコルの最適化:播種密度から剥離工程まで
優れた培地を選定しても、日々の培養操作(プロトコル)が適切でなければ、UC-MSCのポテンシャルを最大限に引き出すことはできません。播種から回収までの各工程におけるパラメータを最適化し、細胞にストレスを与えない環境を整えることが大切です。ここでは、現場ですぐに見直せる具体的なポイントを紹介します。
増殖曲線を最大化するための最適な初期播種密度の設定
培養開始時の細胞密度(播種密度)は、その後の増殖曲線に大きく影響します。密度が低すぎると細胞間のシグナル伝達が不足して増殖が遅れ(Lag phaseの長期化)、高すぎるとすぐに過密状態となり増殖が停止します。
UC-MSCの場合、一般的には2,000〜5,000 cells/cm²程度が目安とされますが、使用する培地や細胞株によって最適値は異なります。予備試験を行い、対数増殖期(Log phase)を長く維持できる最適な密度を設定しましょう。
細胞老化(Senescence)を防ぐための継代タイミングとコンフルエント率の管理
細胞が培養容器いっぱいに増殖する(コンフルエント)まで放置すると、接触阻害により増殖が止まるだけでなく、細胞老化(Senescence)が誘導されたり、幹細胞としての性質が変化したりする恐れがあります。
品質を維持するためには、コンフルエント率が70〜80%に達した段階、つまり対数増殖期の中盤から後半にかけて継代を行うのが鉄則です。常に細胞が活発に分裂できるスペースを確保することが、良好な状態を保つ秘訣です。
トリプシン代替としての組換え酵素を用いた穏やかな細胞剥離技術
継代操作で使用するトリプシンなどのタンパク質分解酵素は、細胞表面のタンパク質にもダメージを与え、細胞の生存率や接着能を低下させる原因となります。特に無血清培養では、細胞が脆弱になっている場合があるため注意が必要です。
近年では、トリプシンの代わりに、よりマイルドに作用する組換え酵素や、温度感受性ポリマーを用いた剥離技術なども開発されています。細胞への物理的・化学的ストレスを最小限に抑える剥離方法の選定も検討してみてください。
酸化ストレスを低減する低酸素培養(Hypoxia)の導入効果
体内のMSCは、通常酸素分圧が低い環境(低酸素状態)に存在しています。一般的な20%酸素濃度での培養は、細胞にとって酸化ストレス過多となる可能性があります。
2〜5%程度の低酸素培養(Hypoxia)を導入することで、活性酸素種(ROS)の蓄積を抑え、増殖能の向上や細胞老化の抑制、さらには幹細胞性の維持に効果があるという報告が増えています。専用のインキュベーターが必要ですが、品質向上のための有効な手段と言えるでしょう。
大量製造に向けた培養方式の転換:2次元培養から3次元培養へ
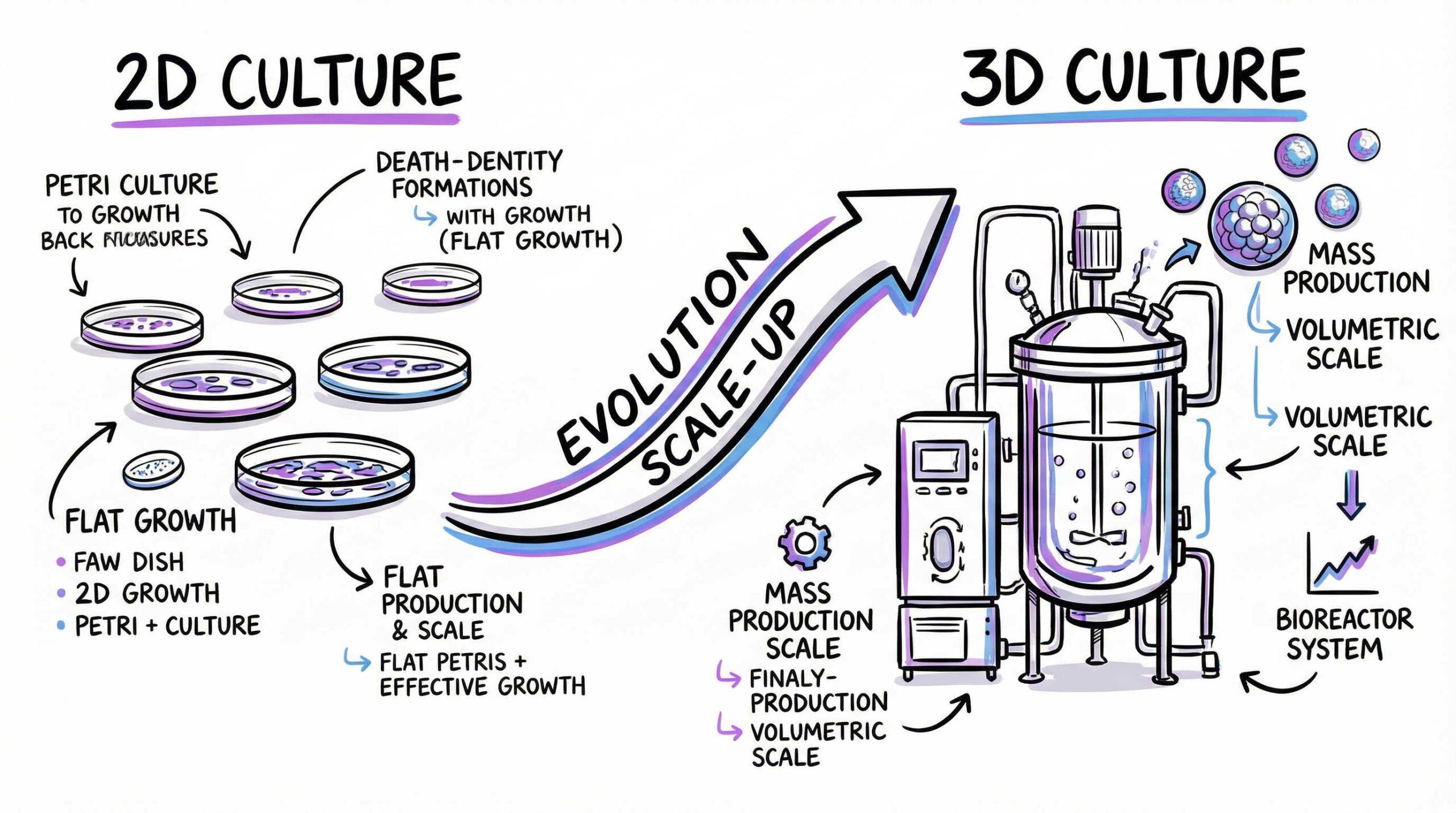
数億から数千億個の細胞が必要となる商業生産において、従来のフラスコを用いた2次元(平面)培養では、スペースや作業量において限界があります。効率的な大量製造を実現するためには、3次元培養への転換が不可欠です。ここでは、スケールアップのための主要な技術とその課題について解説します。
多層フラスコ(Multi-layer Flask)を用いた平面培養の限界とコスト
多層フラスコ(セルスタックなど)は、既存の設備で培養面積を増やせる簡便な方法ですが、スケールアップには限界があります。数千億個の細胞を得るためには膨大な数のフラスコが必要となり、それに伴う培地交換などのハンドリングコストや、廃棄物処理の負担が無視できなくなります。
また、開放系操作が増えることでコンタミネーションのリスクも高まるため、一定規模以上の製造を目指す場合は、より高度なシステムへの移行を検討すべき時期に来ていると言えます。
浮遊培養(サスペンション培養)によるスケールアップの実現可能性
浮遊培養(サスペンション培養)は、タンク型の容器内で細胞を浮遊させて培養する手法で、単位体積あたりの生産性を飛躍的に高めることができます。バイオ医薬品の製造などで実績のある技術であり、省スペースでの大量生産に適しています。
しかし、MSCは本来「足場依存性」の細胞であるため、単独で浮遊させると細胞死(アノイキス)を起こしてしまいます。そのため、MSCの浮遊培養には、細胞を凝集させたスフェロイド(細胞塊)形成などの工夫が必要となります。
マイクロキャリアを用いた撹拌型バイオリアクター(Bioreactor)でのプロセス制御
足場依存性であるMSCの大量培養において最も有望視されているのが、マイクロキャリア(微小なビーズ)を用いた撹拌型バイオリアクターです。マイクロキャリア表面に細胞を接着させることで、擬似的な3次元環境を提供しつつ、タンク内での浮遊培養を可能にします。
この方式では、pH、溶存酸素(DO)、温度などをリアルタイムでモニタリングし、精密に制御(プロセス制御)することが可能です。これにより、バッチ間の品質バラつきを抑えた安定生産が実現します。
剪断応力(Shear Stress)がUC-MSCの品質に与える影響と対策
撹拌型バイオリアクターを使用する際の最大の課題は、撹拌翼の回転によって生じる「剪断応力(Shear Stress)」です。過度な物理的ストレスは、MSCの細胞死や分化誘導、増殖抑制を引き起こす可能性があります。
そのため、効率的な混合と酸素供給を維持しつつ、細胞へのダメージを最小限に抑える撹拌速度や翼の形状の最適化が求められます。流体力学的なシミュレーションなどを活用し、穏やかな培養環境を設計することが成功の鍵となります。
臨床応用を前提とした品質管理(QC)と特性解析
培養技術がいかに高度化しても、最終製品の品質が担保されていなければ意味がありません。特に他家移植が前提となるUC-MSCでは、厳格な品質管理(QC)と特性解析が求められます。国際基準に準拠しつつ、機能性を保証するための評価項目について確認しておきましょう。
国際細胞治療学会(ISCT)の定義に基づく表面抗原マーカー解析
MSCの同定において最も基本的なのが、国際細胞治療学会(ISCT)が提唱するミニマムクライテリアです。具体的には、CD73、CD90、CD105が陽性(95%以上)であり、かつCD14、CD19、CD34、CD45、HLA-DRが陰性(2%以下)であることをフローサイトメトリーで確認します。
これはあくまで「最低限の定義」ですが、ロットごとの均一性を確認するための必須項目として、確実に実施する必要があります。
脂肪・骨・軟骨への三系統分化能の定量的評価
MSCの定義の一つである「脂肪」「骨」「軟骨」への三系統分化能を有していることの確認も重要です。専用の分化誘導培地で培養後、特定の染色法(オイルレッドO、アリザリンレッド、アルシアンブルーなど)を用いて評価します。
単に分化するかどうかだけでなく、画像解析や遺伝子発現解析を用いて定量的に評価することで、細胞の「質」をより客観的に判断できるようになります。
核型解析(Karyotyping)による染色体安定性の確認
長期間の培養や過度な継代は、染色体異常を引き起こすリスクがあります。臨床応用においては、腫瘍形成性などの安全性に関わる重大な問題となり得ます。
そのため、G分染法などの核型解析(Karyotyping)を定期的に実施し、染色体の数や構造に異常がないことを確認する必要があります。近年では、より高感度なaCGH法や次世代シーケンサーを用いた解析も検討されています。
マイコプラズマ否定試験およびエンドトキシン試験による安全性保証
患者様に投与する製剤として、無菌性の保証は絶対条件です。特にマイコプラズマは一般的な光学顕微鏡では発見しにくいため、PCR法や培養法を用いた否定試験が必須となります。
また、発熱物質であるエンドトキシンについても、リムルス試験などで基準値以下であることを確認しなければなりません。これらの試験は製造プロセスの各段階で実施し、安全性を徹底的に担保しましょう。
免疫抑制能やサイトカイン分泌能などの機能的ポテンシーアッセイ
表面マーカーや分化能だけでなく、実際の治療効果に関連する「機能(ポテンシー)」を評価する動きが強まっています。UC-MSCの場合、免疫調節作用が主要なメカニズムの一つと考えられているため、リンパ球増殖抑制試験や、抗炎症性サイトカイン(PGE2、IDO、TSG-6など)の分泌量を測定することが有用です。
自社のターゲット疾患に合わせて適切なポテンシーアッセイを設定することは、製品の価値を証明する上で非常に重要です。
まとめ
臍帯由来MSC(UC-MSC)の培養技術は、単なる「細胞を増やす作業」から、安全性と経済性を両立させた「工業的な製造プロセス」へと進化しています。
臨床応用と産業化を成功させるためには、以下のポイントを総合的に最適化することが重要です。
- 安全性と規制対応: ゼノフリー・無血清培地の採用
- 再現性と効率化: 自動培養装置や閉鎖系システムの導入
- プロセスの最適化: 播種密度、継代タイミング、低酸素培養の活用
- スケールアップ: 3次元培養(バイオリアクター)への移行
- 品質保証: ISCT基準に加え、機能的なポテンシーアッセイの実施
これらの技術的要素を一つひとつ丁寧に検討し、自社の目的や設備に合った最適なプロトコルを構築していくことが、再生医療の発展に寄与する確かな一歩となるでしょう。
臍帯由来MSC(UC-MSC)の培養技術についてよくある質問

以下に、UC-MSCの培養技術に関して、現場の技術者や研究者の方からよく寄せられる質問をまとめました。
- Q1. UC-MSCの増殖速度が急に低下しました。何が原因でしょうか?
- 原因は多岐にわたりますが、まずは「播種密度が低すぎないか」「コンフルエント過密による老化」「培地のロット変更」「マイコプラズマ汚染」を確認してください。特に、継代時のダメージや培地のpH変動も影響します。
- Q2. ウシ胎児血清(FBS)から無血清培地への切り替えはどのように進めるべきですか?
- 急激な切り替えは細胞にストレスを与えます。まずはFBS濃度を徐々に下げながら無血清培地の比率を上げる「馴化(じゅんか)」プロセスを試すか、メーカー推奨のコーティング剤を併用して、細胞の接着をサポートすることをお勧めします。
- Q3. 2次元培養から3次元培養(バイオリアクター)へ移行する適切なタイミングは?
- 必要な細胞数が数億個を超え、手作業でのフラスコ処理が限界(コスト・スペース・人的リソース面)に達した時が検討のタイミングです。ただし、プロトコル確立には時間がかかるため、開発初期からスケーラビリティを考慮しておくのが理想的です。
- Q4. 継代数(PDL)はどこまで許容されますか?
- 一般的にUC-MSCは増殖能が高いですが、PDL 30〜40程度で老化の兆候が見られることが多いです。臨床用としては、染色体異常のリスクや分化能の低下を考慮し、PDL 15〜20程度(P3〜P5)での使用が推奨されるケースが多いです。
- Q5. 凍結保存後の細胞生存率を向上させるコツはありますか?
- 凍結保護剤(DMSOなど)の濃度最適化はもちろんですが、「緩慢凍結(-1℃/min)」を確実に実施すること、そして融解時は「急速融解(37℃)」を行い、速やかにDMSOを除去することが重要です。また、凍結前の細胞状態を良好に保つことも必須です。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "UC-MSCの増殖速度が急に低下しました。何が原因でしょうか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "原因は多岐にわたりますが、まずは「播種密度が低すぎないか」「コンフルエント過密による老化」「培地のロット変更」「マイコプラズマ汚染」を確認してください。特に、継代時のダメージや培地のpH変動も影響します。"
}
},
{
"@type": "Question",
"name": "ウシ胎児血清(FBS)から無血清培地への切り替えはどのように進めるべきですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "急激な切り替えは細胞にストレスを与えます。まずはFBS濃度を徐々に下げながら無血清培地の比率を上げる「馴化(じゅんか)」プロセスを試すか、メーカー推奨のコーティング剤を併用して、細胞の接着をサポートすることをお勧めします。"
}
},
{
"@type": "Question",
"name": "2次元培養から3次元培養(バイオリアクター)へ移行する適切なタイミングは?",
"acceptedAnswer": {
"@type": "Answer",
"text": "必要な細胞数が数億個を超え、手作業でのフラスコ処理が限界(コスト・スペース・人的リソース面)に達した時が検討のタイミングです。ただし、プロトコル確立には時間がかかるため、開発初期からスケーラビリティを考慮しておくのが理想的です。"
}
},
{
"@type": "Question",
"name": "継代数(PDL)はどこまで許容されますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "一般的にUC-MSCは増殖能が高いですが、PDL 30〜40程度で老化の兆候が見られることが多いです。臨床用としては、染色体異常のリスクや分化能の低下を考慮し、PDL 15〜20程度(P3〜P5)での使用が推奨されるケースが多いです。"
}
},
{
"@type": "Question",
"name": "凍結保存後の細胞生存率を向上させるコツはありますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "凍結保護剤(DMSOなど)の濃度最適化はもちろんですが、「緩慢凍結(-1℃/min)」を確実に実施すること、そして融解時は「急速融解(37℃)」を行い、速やかにDMSOを除去することが重要です。また、凍結前の細胞状態を良好に保つことも必須です。"
}
}
]
}
</script>