再生医療の分野において、周産期組織由来細胞(臍帯、胎盤、羊膜など)は、その卓越した生物学的特性と倫理的な利点から、次世代の細胞ソースとして急速に注目を集めています。骨髄や脂肪由来の細胞と比較して、より高い増殖能や低い免疫原性を持つことが示唆されており、難治性疾患に対する新たな治療戦略として期待が高まっています。
本記事では、再生医療の研究者や開発担当者の方々に向けて、周産期組織由来細胞の臨床応用事例を網羅的に解説いたします。最新の臨床試験の動向から、疾患領域別の具体的なエビデンス、そして実用化に向けた課題と規制に至るまで、研究開発や事業化の判断材料となる有益な情報を整理してお届けします。これからの医療を変えうる、この細胞の可能性を共に探っていきましょう。
周産期組織由来細胞の臨床応用における世界的潮流と現状
再生医療のグローバル市場において、周産期組織由来細胞は単なる代替ソースではなく、主要なプレイヤーとしての地位を確立しつつあります。特に、産業化を見据えた他家移植製剤としての開発が活発化しており、世界中で多くの臨床試験が進行中です。ここでは、その市場動向と背景にある要因について詳しく見ていきましょう。
他家移植(Allogeneic)製剤としての市場拡大とポテンシャル
周産期組織由来細胞、特に間葉系幹細胞(MSC)の最大の強みは、他家移植(Allogeneic)製剤としての適性の高さにあります。自家移植(Autologous)と比較して、製造コストの低減や品質の均一化が図りやすく、必要な時に即座に投与できる「オフザシェルフ(Off-the-shelf)」製剤としての開発が進んでいます。
市場調査においても、他家由来MSCの市場規模は年々拡大傾向にあり、その中でも採取量が豊富で増殖能が高い臍帯や胎盤由来の細胞は、大規模な商業生産に適したソースとして、製薬企業やバイオベンチャーからの投資が集中しています。これが、現在の再生医療市場における大きな潮流となっています。
国内外における臨床試験のフェーズ別実施状況
ClinicalTrials.govなどのデータベースを参照すると、周産期組織由来細胞を用いた臨床試験は、アジアや北米を中心に数多く登録されています。初期の安全性確認を主目的としたフェーズ1試験から、有効性を検証するフェーズ2、そして承認取得を目指すフェーズ3試験へと着実にステップアップしている案件が増加しています。
特に、中国や韓国などのアジア諸国では、政府の強力なバックアップもあり、臨床研究から治験への移行が迅速に進んでいます。対象疾患も、移植片対宿主病(GvHD)や自己免疫疾患といった免疫系疾患から、脳梗塞や脊髄損傷といった神経系疾患まで多岐にわたり、グローバルな開発競争が激化している状況です。
臍帯・胎盤由来間葉系幹細胞(MSC)が注目される背景
なぜ今、骨髄や脂肪ではなく、臍帯や胎盤由来のMSCがこれほどまでに注目されているのでしょうか。その背景には、細胞ソースとしての「質の高さ」と「調達の容易さ」があります。
周産期組織は、出産時に医療廃棄物として処理される組織であるため、ドナーへの新たな侵襲がなく、倫理的なハードルが比較的低いという利点があります。加えて、これらの組織から得られる細胞は、成体組織由来の細胞と比較して「若く」、遺伝子の変異蓄積が少ないと考えられています。このように、倫理面と生物学的な質の双方においてメリットが大きいことが、研究開発の現場で選ばれる理由となっています。
骨髄・脂肪由来と比較した周産期組織由来細胞の生物学的有用性
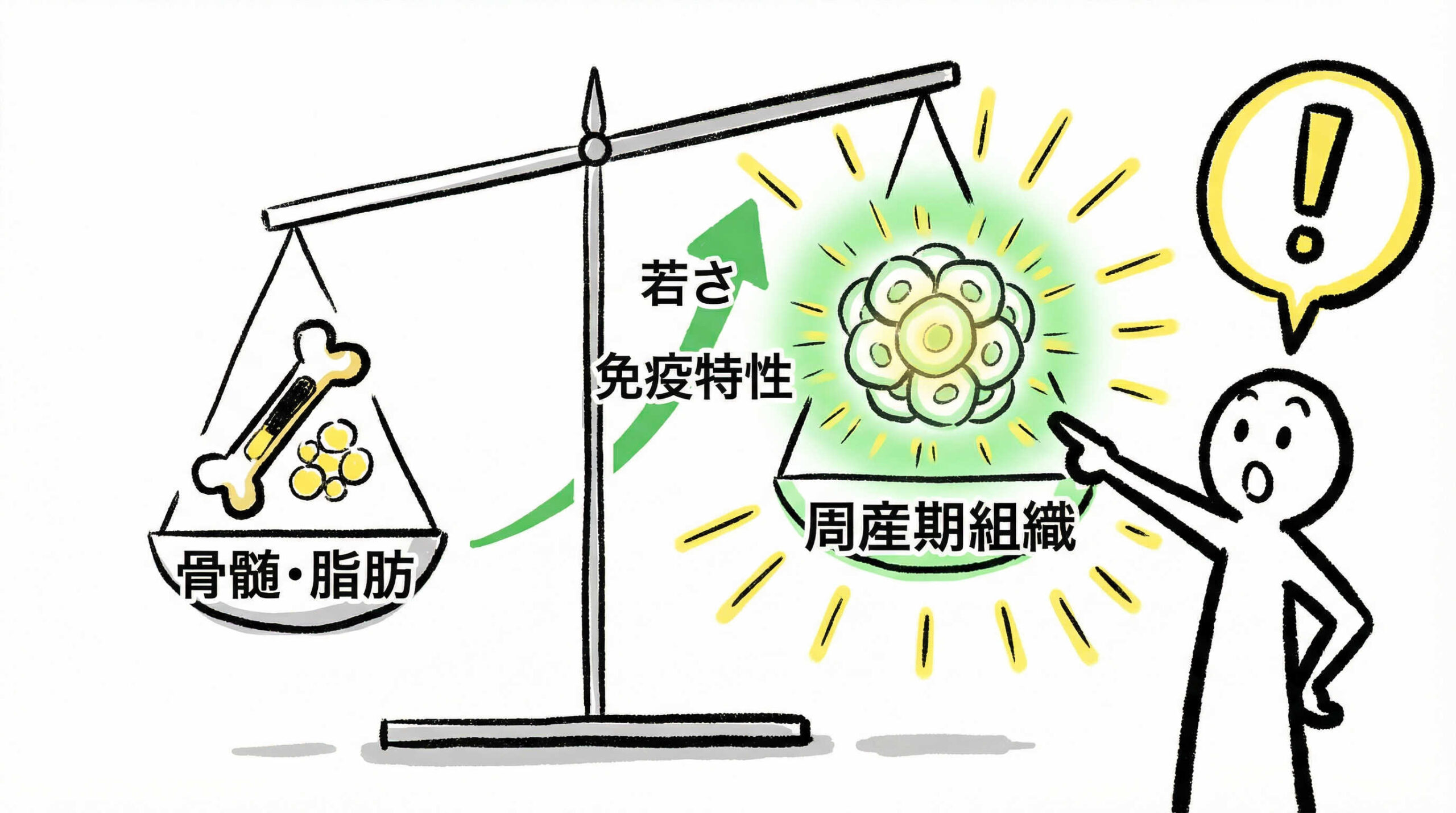
周産期組織由来細胞が臨床応用で優位性を持つ根拠は、その生物学的な特性にあります。従来のゴールドスタンダードであった骨髄由来や、採取が容易な脂肪由来と比較しても、細胞の若さや免疫学的特性において独自のアドバンテージを持っています。ここでは、その具体的な有用性を科学的な視点から解説します。
若年性細胞ゆえの高い増殖能と分化能
周産期組織由来細胞は、個体発生の初期段階に近い組織から採取されるため、成体幹細胞の中でも極めて高い増殖能を保持しています。研究データによれば、骨髄由来MSCと比較してテロメア長が長く、老化マーカーの発現が低いことが報告されています。
この「若さ」は、継代培養を重ねても細胞の特性が維持されやすいことを意味し、少量の組織から膨大な数の細胞を製造する必要がある再生医療製品にとって、決定的なアドバンテージとなります。また、分化能に関しても、骨、軟骨、脂肪への分化だけでなく、神経系や内皮細胞への分化能も高いポテンシャルを示しており、幅広い疾患への応用が期待されています。
低い免疫原性と免疫調節作用による拒絶反応リスクの低減
他家移植を行う上で最大の障壁となるのが拒絶反応ですが、周産期組織由来細胞はこのリスクを低減するユニークな特性を持っています。これらの細胞は、免疫原性に関わるHLA-DR(MHCクラスII)の発現が低く、一方で免疫寛容に関与するHLA-Gを発現しているケースがあります。
さらに、強力な免疫調節作用を持ち、過剰な免疫反応を抑制するサイトカインや因子(PGE2, IDOなど)を分泌します。この「免疫から逃れる性質」と「免疫をなだめる性質」の双方向のアプローチにより、免疫抑制剤の使用を最小限に抑えた他家移植が可能になると考えられており、臨床現場での安全性向上に寄与しています。
ドナーへの身体的侵襲がない採取プロセスの倫理的メリット
骨髄採取や脂肪吸引は、ドナーに対して麻酔や外科的な処置を必要とし、痛みや感染症のリスクといった身体的侵襲を伴います。これに対し、周産期組織由来細胞の採取は、出産後の胎盤や臍帯を使用するため、母体および新生児への身体的負担が一切ありません。
この「非侵襲性」は、ドナーのリクルートを容易にするだけでなく、倫理的な観点からも非常に重要です。ボランティア精神に基づく提供を受けやすく、持続可能な細胞供給システムを構築する上で、極めて合理的な特性であると言えるでしょう。研究者にとっても、倫理審査委員会(IRB)での承認が得られやすいという側面もあります。
均質的な細胞バンク構築の容易さと製造コストへの影響
医薬品としての細胞製剤には、ロット間差の少ない均質な品質が求められます。周産期組織由来細胞は、ドナーの年齢が「0歳(出生時)」で統一されているため、成体ドナーに見られる加齢や生活習慣による細胞品質のばらつきを最小限に抑えることが可能です。
これにより、高品質なマスターセルバンク(MCB)の構築が容易になり、そこからワーキングセルバンク(WCB)を経て大量製造を行うプロセスが安定します。結果として、製造の失敗率(歩留まり)が改善され、製造コストの削減にもつながります。これは、高額になりがちな再生医療製品の薬価を適正化する上でも重要な要素となります。
臨床応用が進む主な周産期組織由来細胞の種類と特性
一口に「周産期組織」といっても、その部位によって採取できる細胞の種類や特性は異なります。臨床開発においては、ターゲットとする疾患や治療メカニズムに合わせて最適な細胞ソースを選択することが重要です。ここでは、主要な細胞種ごとの特徴を整理します。
臍帯由来間葉系幹細胞(UC-MSC)のウォートンジェリー特性
臍帯(へその緒)は、周産期組織の中でも特にMSCの含有量が豊富で、採取効率が良い組織として知られています。特に、臍帯血管を取り巻くゼリー状の組織である「ウォートンジェリー(Wharton’s Jelly)」には、良質なMSCが高密度に含まれています。
ウォートンジェリー由来MSC(WJ-MSC)は、他の組織由来MSCと比較しても増殖スピードが速く、原始的な幹細胞マーカーの発現が高いことが特徴です。また、採取プロセスにおいて血管や上皮組織を分離しやすいため、純度の高いMSC培養が可能であり、現在多くの臨床試験で採用されている主流の細胞ソースの一つです。
胎盤由来間葉系幹細胞(Placenta-MSC)の母体・胎児由来組織の違い
胎盤は母体由来の脱落膜と胎児由来の絨毛膜から構成される複雑な臓器であり、そこから得られる胎盤由来MSC(Placenta-MSC)も多様な特性を持ちます。研究においては、母体由来細胞と胎児由来細胞を明確に区別して抽出する技術が求められます。
胎盤由来MSCは、血管新生因子を豊富に分泌する傾向があり、虚血性疾患への応用が特に期待されています。また、胎盤自体が免疫寛容の最前線であることから、強力な免疫調節能を有しているとも考えられています。ただし、組織構造が複雑であるため、細胞抽出プロセスの標準化が開発上のポイントとなります。
羊膜由来間葉系幹細胞(AMSC)および羊膜上皮細胞の特徴
羊膜は、胎児を直接包んでいる薄い膜であり、ここからは羊膜間葉系幹細胞(AMSC)と羊膜上皮細胞(hAE)の2種類の細胞が得られます。羊膜は血管成分を含まないため、ここから得られる細胞は純度が高く、他家移植時の拒絶反応が極めて起こりにくいという特徴があります。
特に羊膜上皮細胞は、幹細胞様の特性を持ちながらも、神経細胞や肝細胞への分化能が高いことが報告されています。また、強力な抗炎症作用と抗線維化作用を持つため、眼科領域での角膜再生や、肝硬変などの線維化疾患に対する治療応用が進められています。
臍帯血由来細胞の造血幹細胞移植以外の可能性
臍帯血といえば、白血病治療などにおける造血幹細胞移植(CBT)が有名ですが、実は造血幹細胞以外にも多様な細胞が含まれています。近年では、臍帯血中に含まれる微量のMSCや、VSEL(Very Small Embryonic-like)幹細胞などが注目されています。
また、単核球成分全体を利用した脳性麻痺や自閉症スペクトラム障害への臨床研究も行われています。臍帯血由来のMSCは、臍帯組織由来に比べて採取量は少ないものの、血液由来ならではの特性や、公的バンクによる保存体制が整っているインフラ面での利点があり、新たな適応拡大が模索されています。
疾患領域別に見る周産期組織由来細胞の臨床応用事例とエビデンス
周産期組織由来細胞のポテンシャルは、基礎研究の段階を超え、実際の患者様を対象とした臨床試験で次々と実証され始めています。免疫疾患から神経疾患、組織修復まで、その適応範囲は驚くほど広範です。ここでは、主要な疾患領域ごとの具体的な臨床応用事例と、得られているエビデンスについて詳述します。
急性移植片対宿主病(aGvHD)に対するステロイド抵抗性の治療実績
造血幹細胞移植後の重篤な合併症である急性移植片対宿主病(aGvHD)は、周産期組織由来細胞が最も早く実用化された領域の一つです。ステロイドなどの標準治療に反応しない難治性aGvHDに対し、他家MSC製剤が承認されています。
日本国内でも、ヒト間葉系幹細胞製品(テムセルHS注など)が製造販売承認を取得しており、臨床現場で使用されています。これらの細胞は、過剰な免疫反応を抑制し、損傷した組織を修復することで、致死的なGvHDの症状を劇的に改善させる事例が多数報告されており、この分野における確固たるエビデンスとなっています。
脳梗塞および低酸素性虚血性脳症に対する神経再生効果
脳血管障害や新生児の低酸素性虚血性脳症(HIE)に対し、臍帯血や臍帯由来MSCを用いた神経再生医療の研究が進んでいます。これらの細胞が分泌する神経栄養因子や血管新生因子が、損傷した神経組織の保護や修復を促進すると考えられています。
臨床試験では、発症早期の投与による後遺症の軽減や、慢性期における運動機能の改善効果が検証されています。一部の研究では、麻痺の改善やMRI画像上の病変縮小といった有望な結果が得られており、根本的な治療法が乏しい中枢神経疾患に対する新たな光として期待されています。
脳性麻痺(CP)に対する臍帯血・臍帯由来細胞の投与効果
小児領域において特に関心が高いのが、脳性麻痺(CP)に対する細胞治療です。自身の保存済み臍帯血(自家)や、他人の臍帯血・臍帯由来MSC(他家)を輸注することで、運動機能や認知機能の改善を目指す臨床試験が、米国デューク大学をはじめ世界中で実施されています。
メカニズムとしては、抗炎症作用による二次的な脳損傷の抑制や、神経回路の再構築(プラスチシティ)の促進が想定されています。完全な治癒には至らないまでも、粗大運動能力尺度(GMFM)のスコア改善などが報告されており、リハビリテーションとの併用効果についても研究が進められています。
新型コロナウイルス感染症(COVID-19)に伴うARDSへの抗炎症作用
COVID-19のパンデミックに際し、重症肺炎に伴う急性呼吸窮迫症候群(ARDS)の治療として、臍帯由来MSCの投与が緊急的に試みられました。ARDSの本態である「サイトカインストーム(免疫暴走)」を、MSCの強力な免疫制御能で鎮静化させることが目的です。
複数の小規模臨床試験において、生存率の向上や肺機能の回復期間短縮といったポジティブな結果が報告されました。これは、未知の感染症や急性炎症性疾患に対する緊急治療オプションとして、オフザシェルフの周産期組織由来MSCが高い有用性を持つことを示した重要な事例と言えます。
肝硬変・肝不全に対する線維化抑制と組織修復
肝硬変や肝不全といった難治性肝疾患に対し、線維化(組織が硬くなること)の抑制と肝機能の再生を目的とした臨床研究が行われています。周産期組織由来細胞は、肝星細胞の活性化を抑制してコラーゲンの蓄積を防ぐとともに、肝細胞様の細胞への分化や栄養因子の分泌を通じて組織修復を促します。
臨床試験では、MELDスコア(肝予備能の指標)の改善や、腹水の減少といった臨床症状の緩和が観察されています。肝移植ドナー不足が深刻な問題となる中、移植までのブリッジ治療や、移植を回避するための代替療法として研究が加速しています。
膝変形性関節症に対する軟骨再生と疼痛緩和の臨床研究
高齢化社会で患者数が増加している膝変形性関節症(OA)に対し、関節内へのMSC注射による治療開発が進んでいます。臍帯や羊膜由来の細胞は、抗炎症作用による疼痛緩和に加え、摩耗した軟骨の再生を促す効果が期待されています。
既存のヒアルロン酸注射やステロイド注射が対症療法に留まるのに対し、細胞治療は疾患修飾(病気の進行を遅らせる、あるいは治す)の可能性を秘めています。臨床試験では、疼痛スコア(VAS)や関節機能評価(WOMAC)の有意な改善が報告されており、人工関節置換術の手前の選択肢として注目されています。
糖尿病性足潰瘍および重症虚血肢に対する血管新生療法
重症虚血肢(CLI)や難治性の糖尿病性足潰瘍は、放置すれば下肢切断に至る深刻な病態です。血管新生能に優れた周産期組織由来細胞(特に胎盤や臍帯由来)を患部に投与することで、微小血管の新生を促し、血流を改善させる治療法(血管新生療法)が開発されています。
臨床試験の結果、潰瘍の閉鎖率向上や、切断回避率の改善、安静時疼痛の軽減といった効果が示されています。血行再建術が困難な症例に対する「最後の砦」として、細胞治療製品の実用化が強く望まれている領域です。
クローン病などの自己免疫疾患に対する免疫制御アプローチ
クローン病や潰瘍性大腸炎、全身性エリテマトーデス(SLE)などの自己免疫疾患に対しても、周産期組織由来細胞の免疫調節作用が応用されています。特にクローン病に伴う難治性瘻孔(ろうこう)に対しては、局所投与による瘻孔閉鎖効果が確認されており、一部の国では既に製品化されています。
全身投与による全身性自己免疫疾患へのアプローチも研究されており、既存の生物学的製剤や免疫抑制剤でもコントロール不良な患者層に対し、寛解導入やステロイド減量効果をもたらす新たな治療戦略としてエビデンスが蓄積されつつあります。
周産期組織由来細胞を用いた臨床開発における課題と規制
数多くの有望な臨床データが得られている一方で、周産期組織由来細胞が広く一般医療として普及するためには、乗り越えるべきいくつかの壁が存在します。製造技術、品質管理、そして法規制の側面から、現在直面している課題と解決への取り組みについて解説します。
細胞の品質管理(CMC)における不均一性の克服
細胞製剤、特に他家由来の製品において最も難しいのが、品質の均一性を担保することです。周産期組織はドナー(母体や胎児)の遺伝的背景が異なるため、採取される細胞の特性にも個体差が生じます。
この「不均一性」を克服するためには、効能に関連する重要な品質特性(CQA)を特定し、厳格なドナースクリーニング基準を設ける必要があります。また、製造ロットごとのばらつきを最小限に抑えるための品質管理試験(ポテンシーアッセイなど)の開発が急務となっており、規制当局もこの点を厳しく審査する傾向にあります。
大規模製造における培養プロセスの標準化と自動化
多くの患者に製品を届けるためには、実験室レベルの手作業から、工業レベルの大量製造へとプロセスを移行させる必要があります。しかし、接着依存性の細胞であるMSCを大量に培養するには、広大な培養面積が必要です。
現在、多層培養フラスコやバイオリアクター(浮遊培養装置)を用いた自動培養システムの導入が進められています。製造プロセスの自動化は、コンタミネーション(汚染)リスクの低減や人件費の削減にも寄与しますが、スケールアップに伴う細胞特性の変化(老化や分化)を防ぐための技術的な最適化が依然として大きな課題です。
再生医療等安全性確保法および薬機法における承認プロセスの現状
日本においては「再生医療等安全性確保法」と「医薬品医療機器等法(薬機法)」のダブルトラックでの規制運用がなされています。特に企業治験を経て承認を目指す場合、条件付き・期限付き承認制度などの早期承認スキームが存在しますが、その適用条件や求められるデータのレベルは高度です。
PMDA(医薬品医療機器総合機構)との対面助言などを通じて、開発早期から規制要件をクリアするための戦略を練ることが不可欠です。国際的なハーモナイゼーションも進んでいますが、国ごとに異なる規制に対応するための開発コストも無視できない課題となっています。
腫瘍形成性リスクに対する長期的な安全性評価の必要性
周産期組織由来細胞は、ES細胞やiPS細胞に比べて腫瘍化リスクは極めて低いとされていますが、増殖能が高い細胞である以上、造腫瘍性の評価は避けて通れません。特に、培養過程での染色体異常の有無や、長期的な体内での挙動については慎重な確認が求められます。
臨床試験においても、有効性だけでなく、投与後数年単位での安全性フォローアップが必須となります。異所性組織形成や腫瘍発生のリスクを科学的に否定し、長期的な安全性を担保するデータの蓄積が、医療従事者や患者からの信頼獲得には不可欠です。
まとめ
周産期組織由来細胞は、その高い増殖能、低い免疫原性、そして倫理的な採取メリットにより、再生医療の新たなスタンダードとなりつつあります。GvHDや脳梗塞、肝硬変など、幅広い疾患領域で臨床応用が進み、具体的な治療効果を示すエビデンスも蓄積されてきました。
品質管理や大量製造といった課題は残されていますが、技術革新と規制の整備により、これらは着実に解決へと向かっています。研究者や開発担当者にとって、この細胞ソースは未踏の医療ニーズに応える強力なツールであり、今後の医療を支える重要な基盤となっていくことでしょう。
周産期組織由来細胞の臨床応用事例についてよくある質問
以下に、周産期組織由来細胞の臨床応用に関して、研究者や開発担当者の方からよく寄せられる質問をまとめました。
- 周産期組織由来細胞とiPS細胞の主な違いは何ですか?
- iPS細胞は人工的に作製された多能性幹細胞であり、あらゆる細胞に分化できる反面、腫瘍化リスクや分化誘導の手間があります。一方、周産期組織由来細胞(MSCなど)は体性幹細胞であり、分化能は限定的ですが、腫瘍化リスクが低く、そのまま培養して使用できるため、実用化のハードルが比較的低いのが特徴です。
- 他家移植における拒絶反応は本当に問題になりませんか?
- 周産期組織由来MSCは免疫原性が低く、免疫抑制作用も持つため、HLAが完全に一致しなくても重篤な拒絶反応は起きにくいとされています。ただし、抗HLA抗体の産生などは起こりうるため、臨床試験では安全性評価の一環として免疫反応のモニタリングが慎重に行われます。
- 臨床試験を開始するにあたり、どの組織(臍帯、胎盤、羊膜)を選ぶべきですか?
- ターゲットとする疾患の病態生理によります。例えば、高い増殖能が必要なら臍帯(ウォートンジェリー)、血管新生を重視するなら胎盤、眼科領域や抗炎症を重視するなら羊膜など、各組織の特性と疾患ニーズをマッチングさせることが重要です。
- 日本国内で周産期組織由来細胞の治験を行う際の相談先は?
- 医薬品としての承認を目指す場合は、PMDA(医薬品医療機器総合機構)の対面助言を利用するのが一般的です。臨床研究として実施する場合は、認定再生医療等委員会での審査が必要となります。開発戦略に応じて適切な規制パスを選択してください。
- 細胞の保存期間や輸送方法に課題はありますか?
- 凍結保存技術の進歩により、長期間の保存が可能になっています。しかし、解凍後の細胞生存率(Viability)の維持や、医療機関までの輸送中の温度管理(コールドチェーン)は重要課題であり、製品開発においては専用の輸送容器やプロトコルの確立が必須です。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "周産期組織由来細胞とiPS細胞の主な違いは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "iPS細胞は人工的に作製された多能性幹細胞であり、あらゆる細胞に分化できる反面、腫瘍化リスクや分化誘導の手間があります。一方、周産期組織由来細胞(MSCなど)は体性幹細胞であり、分化能は限定的ですが、腫瘍化リスクが低く、そのまま培養して使用できるため、実用化のハードルが比較的低いのが特徴です。"
}
},
{
"@type": "Question",
"name": "他家移植における拒絶反応は本当に問題になりませんか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "周産期組織由来MSCは免疫原性が低く、免疫抑制作用も持つため、HLAが完全に一致しなくても重篤な拒絶反応は起きにくいとされています。ただし、抗HLA抗体の産生などは起こりうるため、臨床試験では安全性評価の一環として免疫反応のモニタリングが慎重に行われます。"
}
},
{
"@type": "Question",
"name": "臨床試験を開始するにあたり、どの組織(臍帯、胎盤、羊膜)を選ぶべきですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "ターゲットとする疾患の病態生理によります。例えば、高い増殖能が必要なら臍帯(ウォートンジェリー)、血管新生を重視するなら胎盤、眼科領域や抗炎症を重視するなら羊膜など、各組織の特性と疾患ニーズをマッチングさせることが重要です。"
}
},
{
"@type": "Question",
"name": "日本国内で周産期組織由来細胞の治験を行う際の相談先は?",
"acceptedAnswer": {
"@type": "Answer",
"text": "医薬品としての承認を目指す場合は、PMDA(医薬品医療機器総合機構)の対面助言を利用するのが一般的です。臨床研究として実施する場合は、認定再生医療等委員会での審査が必要となります。開発戦略に応じて適切な規制パスを選択してください。"
}
},
{
"@type": "Question",
"name": "細胞の保存期間や輸送方法に課題はありますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "凍結保存技術の進歩により、長期間の保存が可能になっています。しかし、解凍後の細胞生存率(Viability)の維持や、医療機関までの輸送中の温度管理(コールドチェーン)は重要課題であり、製品開発においては専用の輸送容器やプロトコルの確立が必須です。"
}
}
]
}
</script>